Nanoparticule inteligente pentru livrarea de agenți otoprotectori ai urechii interne - NANOSMART
- Detalii
- Accesări: 2369
Denumire proiect: Nanoparticule inteligente pentru livrarea de agenți otoprotectori ai urechii interne
Acronim: NANOSMART
Competiție: PNCDI III - Program 2 - Subprogram 2.1.
Cod proiect: PN-III-P2-2.1-PED-2019-3813
Echipa proiectului
Director de proiect: Conf.dr. Alma Maniu
Instituție coordonatoare: Universitatea de Medicină și Farmacie "Iuliu Hațieganu" Cluj Napoca
- Alma AureliaManiu- director de proiect
- Violeta Necula – membru cercetător
- Adrian Florea - membru cercetător
- Cristina Maria Blebea - membru cercetător
- Stamate Mirela Cristina - membru cercetător
- Ujvari Laszlo Peter - membru cercetător
Parteneri
Institutul Oncologic Prof.Dr.I.Chiricuță Cluj Napoca – P1
- Maria Perde-Schrepler – lider de echipă P1
- Virag Piroska - membru cercetător
- Eva Fischer-Fodor- membru cercetător
- Ioana-Carmen Brie - membru cercetător
- Marilena Vicovan – membru tehnic (statistician)
Universitatea Babeș Bolyai Cluj Napoca – P2
- Monica Potara – lider de echipă P2
- Timea Nagy-Simon - membru cercetător
- Simion Astilean - membru cercetător
Budget: 600.000,00 RON (2 ani)
Rezumat
Surditatea neurosenzorială reprezintă pierderea ireversibilă a celulelor neurosenzoriale cohleare, ca urmare a expunerii la zgomot intens sau medicamente ototoxice. Dexametazona (Dex) este frecvent folosită pentru tratamentul unor afecțiuni ale urechii interne, ca urmare a activității sale antioxidante. Tratamentul afecțiunilor urechii interne este dificil datorită barierelor anatomice și fiziologice. În proiectul nostru, se vor sintetiza nanostructuri noi ca platforme de livrare a Dex în urechea internă: NP de aur învelite în chitosan sau Pluronic, NP de chitosan și NP de Pluronic. Formarea NP și încărcarea cu Dex, stabilitatea acestora în diferite condiții de mediu și experimentale vor fi monitorizate prin spectroscopie UV-vis-NIR, microscopie electronică de transmisie (TEM), împrăștierea dinamică a luminii, spectroscopie în infraroșu și spectroscopie de absorbție atomică. Se vor estima de asemenea, eficiența de încapsulare și de eliberare a Dex. NP vor fi testate in vitro pe linia celulară HEI-OC1: preluarea NP de către celule se va evalua prin microscopie în câmp întunecat, în fluorescență și electronic, precum și prin spectroscopie de absorbție atomică. Efectele biologice ale NP vor fi evaluate prin teste de citotoxicitate (Alamar blue), producerea ROS (H2DCFDA), apoptoza (Anexina V și PI), producerea de citokine (ELISA). Studiul in vivo se va face pe șobolani la care se va induce surditate prin tratament sistemic cu Cisplatin. NP vor fi administrate intratimpanic. După 24h și 48h, se vor înregistra potențialele evocate auditive, iar cohleilor recoltate vor servi drept instrumente de dozare a Dex prin HPLC din perilimfă, vor fi analizate imunohistochimic, prin TEM pentru observarea afectării celulelor neurosenzoriale și localizarea NP în structurile urechii interne. Prin studiul nostru se vor obține noi nanomateriale cu potențial de utilizare ca agenți terapeutici, pe baza unor argumente științifice.
Obiectiv
Hipoacuzia senzorială reprezintă una dintre cele mai frecvente dizabilități umane, cauzată de sunete intense și medicamente ototoxice (de exemplu, aminoglicozide, cisplatină). Afectează aproximativ 1 din 10 persoane și este ireversibilă. Tratarea tulburărilor urechii interne rămâne dificilă din cauza barierelor anatomice și fiziologice. În prezent, administrarea sistemică a medicamentului este considerată prima modalitate de tratament de linie pentru tulburările urechii interne, dar aportul limitat de sânge al urechii interne și pătrunderea relativ slabă a barierei sangvine - labirintice (BLB) vor duce la concentrația locală subterapeutică a medicamentului. Injecțiile intratimpanice (IT) livrează medicamente către urechea internă prin membrana fereastrei rotunde (RWM), ducând la concentrații semnificativ mai mari de medicamente în urechea internă. Datorită limitării livrării convenționale de medicamente, a existat un interes crescut de a explora potențialul nanoparticulelor (NP) pentru administrarea intracocleară a medicamentelor. NP-urile pot fi utilizate atât pentru stabilizarea medicamentelor in vivo, cât și pentru transportarea medicamentelor în cohlee. NP-urile pot încapsula agenți terapeutici și sunt capabili să traverseze RWM. Scopul nostru este de a sintetiza nanoparticule de aur, polimerice capabile să livreze Dexametazonă (Dex) în concentrații terapeutice către urechea internă. NP-urile propuse vor fi: nanoparticule de aur acoperite cu chitosan (chit-AuNPs), nanoparticule de aur acoperite cu Pluronic (Plu-AuNPs), nanoparticule de chitosan (Chit-NPs) și nanoparticule Pluronic (Plu-NPs). Deoarece Dex este un medicament slab solubil în apă, polimerul Pluronic și biopolimerului chitosan vor fi utilizate pentru încapsulare. Ambele au proprietăți fizico-chimice favorabile pentru aplicații biomedicale: biocompatibilitate excelentă, biodegradabilitate, nu sunt toxice sau cancerigene sau imunogene având, de asemenea, efect antibacterian și un comportament dependent de pH. Aceste nanomateriale vor fi validate in vitro și modele in vivo și ar putea fi utilizate în continuare în studiile clinice.
Obiective specifice
Această propunere își propune să ofere:
- nanostructuri noi și versatile care vor livra dexametazonă în celulele senzoriale ale urechii interne in vitro și in vivo: nanoparticule de aur acoperite cu chitosan (Chit-AuNPs), nanoparticule de aur acoperite cu Pluronic (Plu-AuNPs), nanoparticule de chitosan (Chit-NPs) și nanoparticulele Pluronic (PluNPs) vor fi fabricate și utilizate ca platforme de livrare a medicamentelor;
- o evaluare amplă a transformărilor suferite de nanoparticule în setările biologice, corelate cu efectele asupra celulelor tratate: evaluarea absorbției și citotoxicității, a nanoparticulelor in vitro în funcție de concentrație, dimensiune și timpul de incubație pe celule senzoriale ale urechii interne (linia celulară HEI-OC1);
- o evaluare in vivo a efectului protector al NP-urilor injectate intratimpanic după inducerea pierderii auzului cu Cisplatin intravenos; o evaluare a efectului protector al nanoparticulelor încărcate cu Dexametazonă în comparație cu efectul Dex singur;
- extrapolarea modelelor experimentale, oferind o demonstrație experimentală pentru utilizarea acestor nanomateriale în studii clinice ulterioare, a efectelor protectoare ale acestor NP asupra celulelor senzoriale ale urechii interne, afectate de tratamente ototoxice.
Rezultate obținute în proiect
Etapa 1/2020
Elaborarea protocoalelor de sinteza a noilor nanostructuri, elaborarea protocoalelor de studiu in vitro si in vivo. Strategii de obtinere a nanoparticulelor. Protocoale experimentale
P2-UBB.
Protocoale de sinteză a noilor nanomateriale pentru livrarea Dexametazonei către urechea internă. Studiu bibliografic amplu legat de designul nanomaterialelor pentru livrarea Dexametazonei (Dex) către urechea internă, și a identificat următoarele protocoale de sinteză:
- Micelii de Pluronic încărcate cu Dex prin metoda emulsificării
- Nanoparticule de aur (GNP) sintetizete prin metoda Turkevich-Frens prin reducerea sării de aur cu citrat de sodiu, învelirea acestora în Pluronic și încărcarea cu Dex prin metode fizice (încapsulare, adsorbție)
- Nanoparticule de chitosan încărcate cu Dex prin metoda de gelificare ionică
- Nanoparticule de aur (GNP) în chitosan sintetizate într-un singur pas prin reducerea sării de aur cu chitosan și încărcare cu Dex prin metode fizice (încapsulare, adsorbție)
P1-IOCN
Elaborarea modelelor experimentale in vitro, realizarea culturilor de celule neurosenzoriale HEI-OC1. Elaborarea protocoalele de laborator pe baza carora se va desfasura studiul.
- Mentinerea in cultura a liniilor de cellule HEI-OC1
- Determinarea preluarii NP de catre cellule prin:
- Microscopie electronica de transmisie TEM.
- Spectrometrie atomica de absorbtie. - Evaluarea efectului NP asupra viabilitatii celulelor aparatului auditiv.
- Detectarea apoptozei
- Microscopie in fluorescenta
- Evaluarea stressului oxidativ produs de NP
- Evaluarea efectului asupra sistemului imun- secretia de cytokine inflamatorii TNFα si IL6 prin ELISA.
CO-UMF
Elaborarea protocoalelor experimentale in vivo.
Se folosesc pe post de bioreactor șobolani Wistar. Acestora li se induce ototoxicitate prin administrare intraperitoneală de cisplatin, iar apoi prin injectare transtimpanică li se vor administra atât dexametazonă simplă, cât și nanoparticule încărcate cu dexametazonă pentru a compara nivelul otoprotecției oferite de nanoparticulele încărcate cu dexametazonă împotriva efectului ototoxic al cisplatinului. Protocol de evaluare a efectelor tratamentului cu NP nou sintetizate la nivelul cohleei animalelor de experientă
- Protocol de evaluare a ototoxicității induse de cisplatin. Stabilirea dozelor de lucru
- Studiu: Evaluarea prin TEM a preluării NP de către animalele de experiență
- Studiu: Evaluarea efectului protector al Dexametazonei și al NP încărcate cu Dexametazonă împotriva ototoxicității induse de Cisplatin
- Studiu: Evaluarea prin TEM a preluării NP încărcate cu dexametazonă de către celulele neurosenzoriale la animalele de experienta
Etapa 2/2021
P2- UBB
Activitatea 2.1.1. Fabricarea nanoparticulelor de aur (GNP) cu chitosan și aur cu pluronic, înglobarea Dex și caracterizarea acestora din punct de vedere fizico-chimic. Activitatea 2.2.2. Testarea GNP pe modelele in vitro si in vivo. Evaluarea internalizarii si a efectelor biologice.
Fabricarea nanoparticulelor de aur stabilizate cu Pluronic și încărcare cu Dexametazonă
Activitatea 2.2 – Studiul pe culturi de celulele HEI-OC1 al efectului nanostructurilor sintetizate asupra celulelor neurosenzoriale, evaluarea preluarii NP de catre celule.
Studiul preluării NP de către celule prin absorbție atomică
Cantitatea de aur internalizată în celule exprimată procentual față de concentrația de aur incubată.Concentratia de Au detectata in celulele HEI-OC1 a fost proportionala cu concentratia de NP administrata si timpul de incubatie. Se constata o mai buna internalizare a NP cu chitosan comparativ cu cele cu Pluronic.
Studiul preluării NP de către celule prin microscopie în câmp întunecat
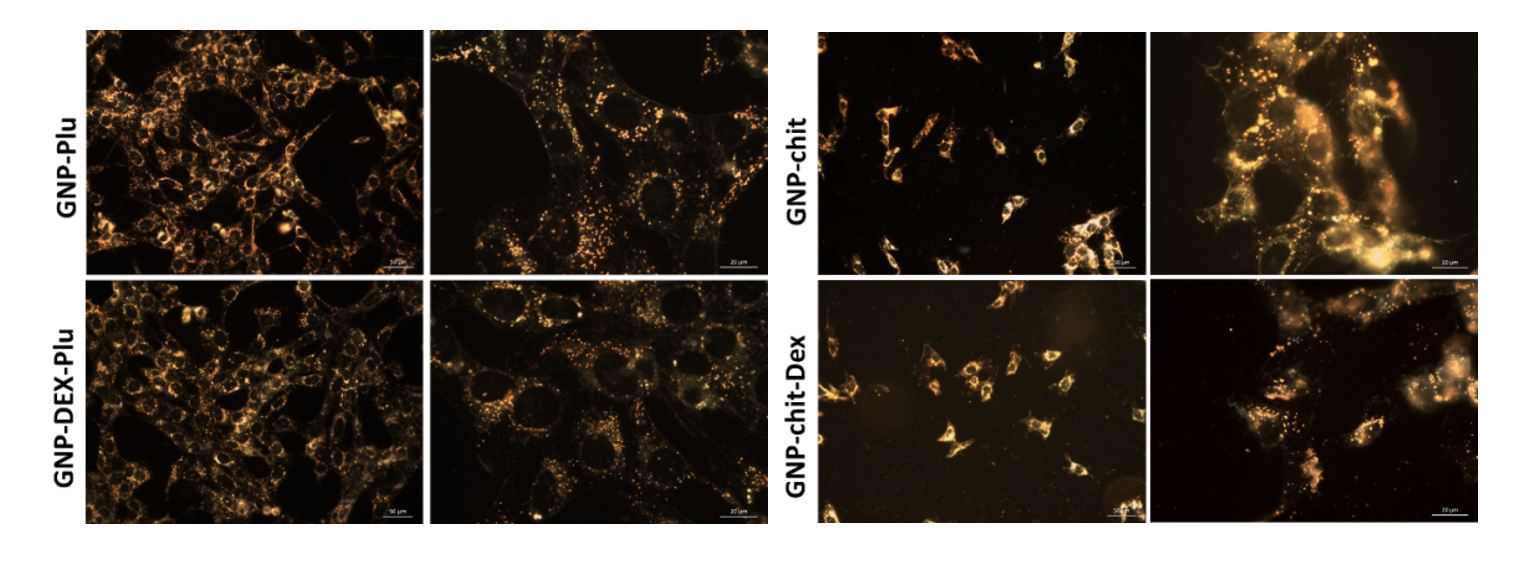
Figura 3. Imagini de microscopie în câmp întunecat ale celulelor HEI-OC1 incubate cu nanoparticule și fără nanoparticule (control)
P1 – IOCN
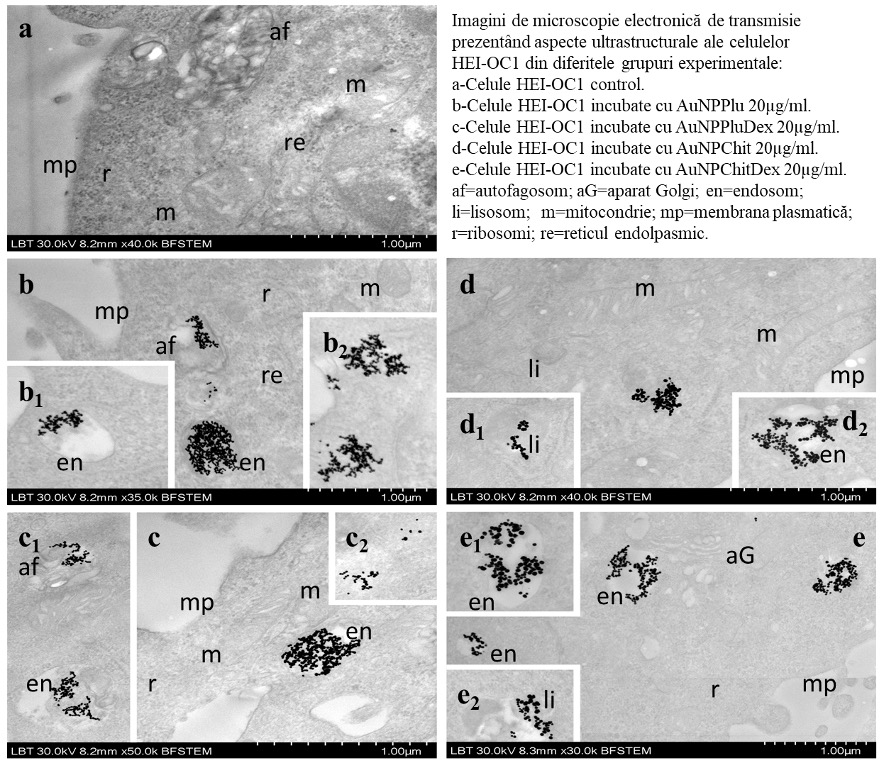
Activitatea 2.2.3 –(CO – UMF si P1-IOCN) Evaluarea prin TEM a preluarii NP de catre celulele HEI-OC1
Activitatea 2.2.1.Stabilirea concentratiilor netoxice de lucru prin teste de citotoxicitate.
Acest deziderat s-a realizat prin efectuarea testului de citotoxicitate MTT utilizand dilutii seriate din solutiile de NP. Toxicitatea acestor NP a fost direct proportionala cu concentratia.
Activitatea 2.3.1 – (P1 – IOCN) Evaluarea producerii apoptozei, eliberarii de specii libere de oxigen, a producerii de citokine inflamatorii in urma tratamentului in vitro al celulelor cu NP. Eliberarea de specii reactive de oxygen (ROS). cu 2’,7’ – cu dichlorofluorescin diacetate
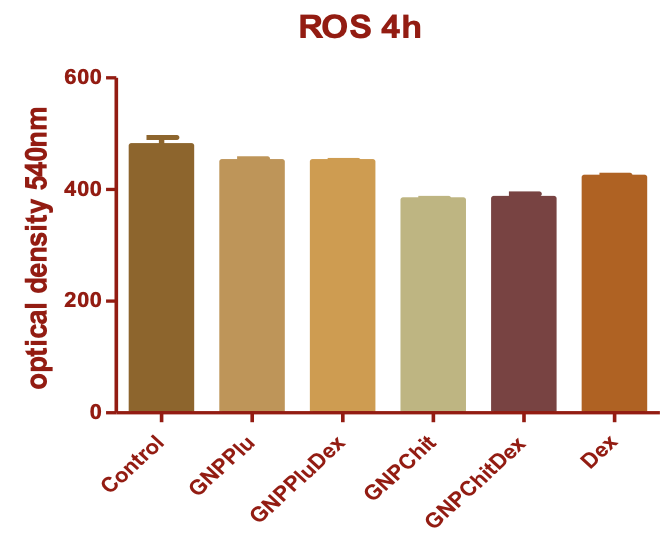
Tratamentul cu NP nu a produs o crestere a eliberarii de ROS pentru nici unul din tipurile de NP studiate.
- Apoptoza
Evaluarea procentului de celule care mor prin apoptoza in urma administrarii NP de aur cu Pluronic si chitosan incarcate sau nu cu Dexametazona s-a facut prin flow-citometrie, celulele fiind marcate cu kitul de Anexina V- Alexa Fluor 488 si iodura de propidium.
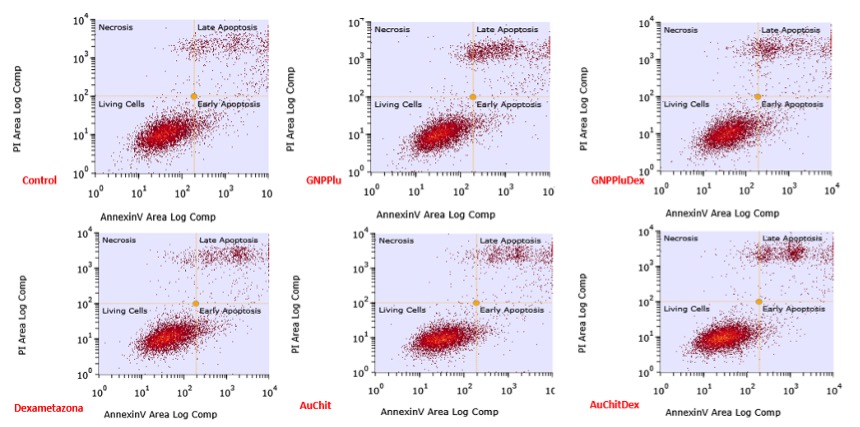
Analiza flow-citometrica a celulelor HEI-OC1 dupa 4h de incubatie cu GNPPlu (b), GNPPluDex (c), Dexametazona (d), AuChit (e) si AuChitDex (f) precum si a celulelor control netratate (a). Celulele au fost marcate cu Anexina V-Alexa fluor 488 si iodura de propidiu.
Secretia de citokine inflamatorii- ELISA
Se constata absenta secretiei crescute in cazul ambelor citokine dupa administrarea NP de Au in comparatie cu controlul.
CO-UMF. Studiu experimental in vivo.
Determinări funcționale audiologice
Inregistrarile ABR au fost efectuate într-o camera cu sistem de atenuare a sunetului, cu ecranare electrică, la o temperatura constanta de 23±1˚.
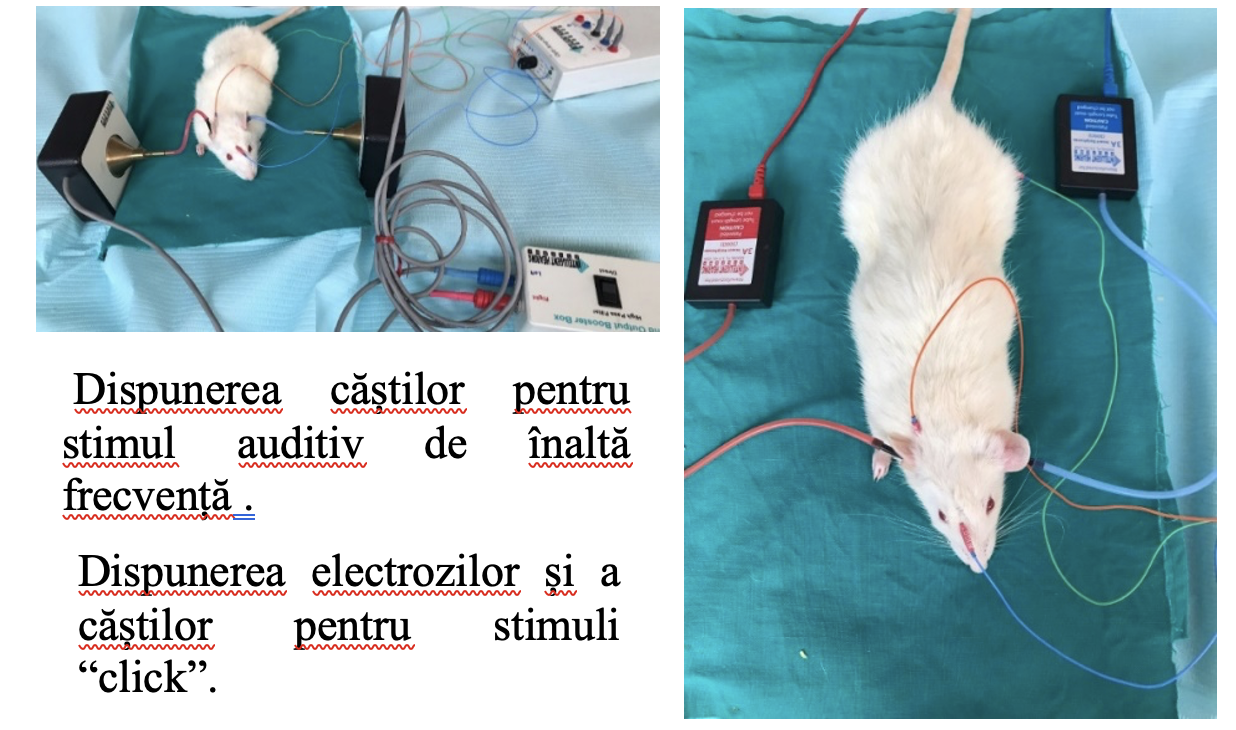
Injectarea de GNP s-a realizat sub control endoscopic.S-au repetat determinările audiologice la 48 de ore post injectare. Nu au fost evidențiate diferențe între pragurile auditive după injectarea NP comparativ cu pragurile inițiale indiferent concentrații sau de stimulul auditiv folosit (click sau pure tone).
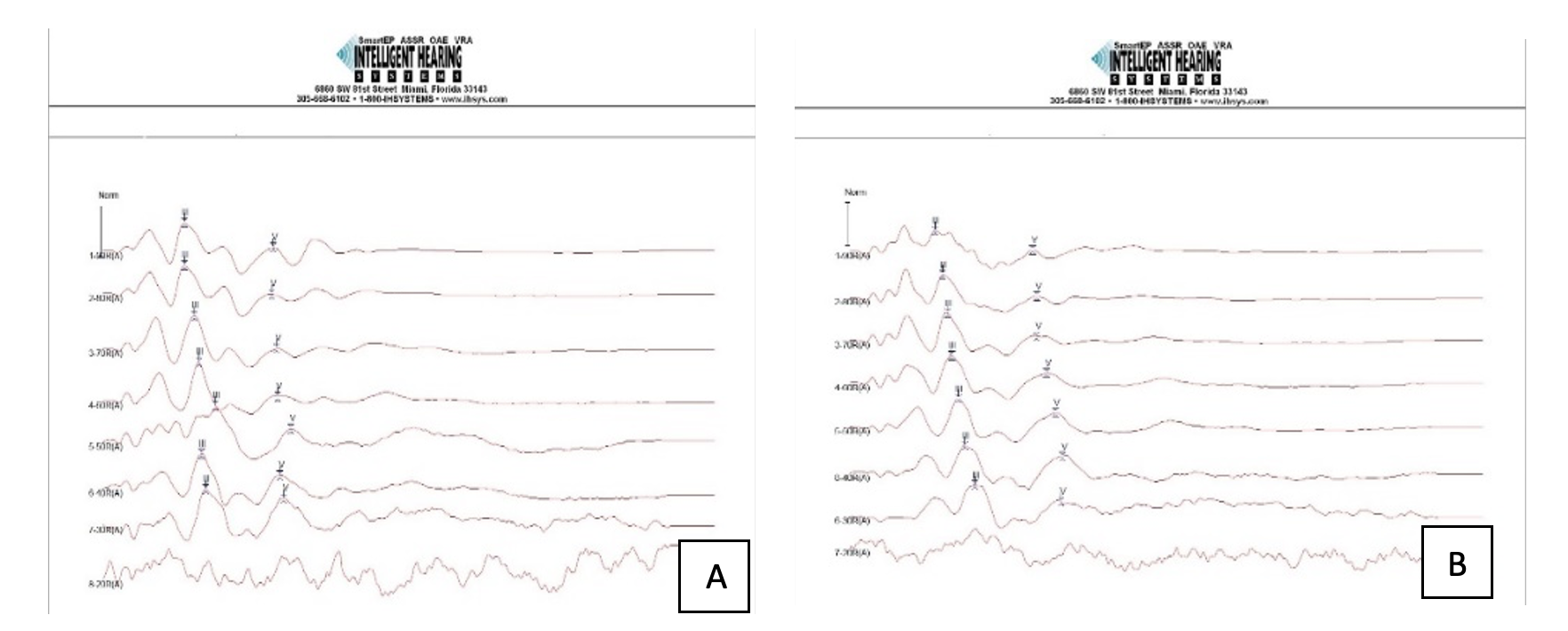
A- rezultate ABR cu stimulare “click” înainte de administrare NP; B- ABR după administrare 40µl NP cu concentrație 100µg/ml, transtimpanic; în ambele măsurători se deceleaza unde reproductibile până la 30dB SPL.
Examen histopatologic
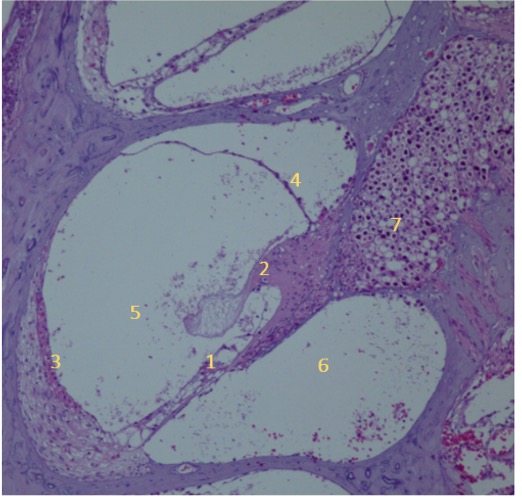
Elementele cohleei nu prezintă modificări specifice unei reacții inflamatorii; magnificație 10X, colorație HE. 1. membrana bazilară; 2. membrana tectoria; 3. stria vascularis; 4. membrana Reissner; 5. rampa vestibulară; 6. rampa timpanică; 7. fibre nervoase
Prin faptul că nu am observat modificari ale potentialelor evocate auditiv după administrarea nanoparticulelor și de asemenea structurile urechii interne evidențiate la examen microscopic nu au suferit modificări ca reacție a unui proces inflamator, putem considera că ambele concentrații de nanoparticule pot fi folosite în siguranță în următoarea etapă a proiectului.
Rezultate finale în ceea ce privește îndeplinirea obiectivelor proiectului
Primul obiectiv al proiectului a fost îndeplinit total, prin obținerea unor nanostructuri noi și versatile pentru livrarea Dex către celulele ciliate ale urechii interne, in vitro și in vivo: NP de aur (GNP), NP de aur acoperite cu chitosan (GNPChit), NP de aur acoperite cu Pluronic (GNPPlu), NP de chitosan (NPChit), micelii de Pluronic (MiceliiPlu), micelii de Pluronic încapsulate cu Dex (MiceliiPluDex) și nanoparticule de chitosan încapsulate cu Dex (NPChitDex)
În alegerea metodelor de sinteză și conjugare/încărcare cu Dex s-a ținut cont de: biocompatibilitatea probelor, livrarea medicamentului în forme nemodificate și posibilitatea eliberării prelungite a medicamentului.
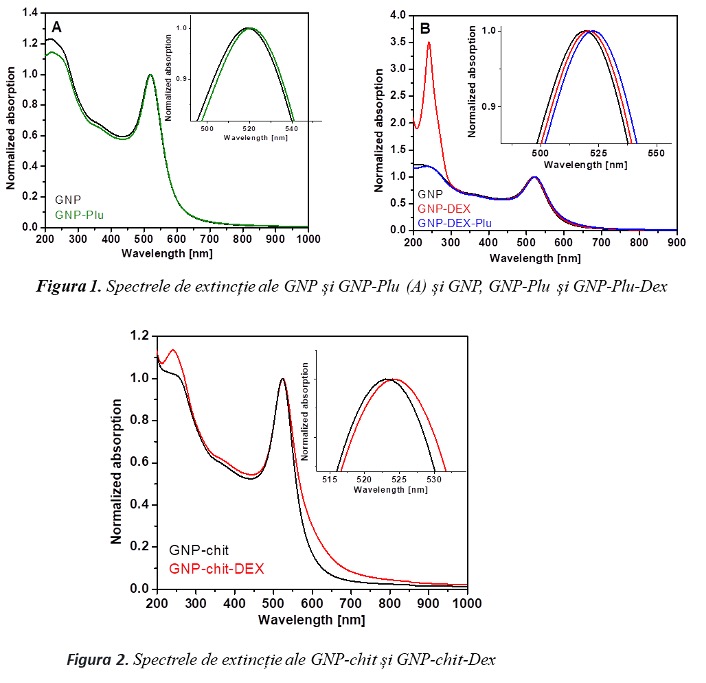
Nanoparticulele de aur au fost sintetizate prin metoda Turkevich-Frens prin reducerea sării de aur cu citrat de sodiu rezultând nanoparticule sferice individuale cu un diametru mediu de 14±1 nm. Cu scopul de a le conferi stabilitate în mediu biologic, nanoparticulele preparate au fost acoperite cu Pluronic F127. Ulterior s-a efectuat și încărcarea cu Dexametazonă. Nanoparticulele de aur stabilizate cu chitosan (GNPChit) au fost sintetizate printr-o metodă de preparare într-un singur pas, prin reducerea clorurii aurice cu chitosan de masă moleculara mare. Încărcarea GNPChit cu Dex a fost realizată prin metode fizice (încapsulare, adsorbție). Suspensiile micelare obținute au fost caracterizate prin măsurători de împrăștiere dinamică a luminii (DLS), potențial Zeta, absorbție UV-Vis și microscopie electronică de transmisie (TEM). Măsurătorile de potențial zeta și DLS au fost efectuate la temperatura de 37°C. Suspensiile apoase de nanoparticule de chitosan încapsulate cu Dex (NPChitDex) au fost sintetizate prin metoda de gelificare ionică iar caracterizarea suspensiilor apoase de nanoparticule a fost realizată prin măsurători DLS, potențial Zeta, absorbție UV-Vis. Prin prisma acestor teste, s-a evidențiat buna stabilitate în soluții și potențiala biocompatibilitate.
Al 2-lea obiectiv al proiectului, de asemenea îndeplinit în totalitate, a constat în evaluarea modificărilor NP în condiții biologice, în corelație cu efectele asupra celulelor tratate. Pentru aceasta au fost puse la punct, implementate și utilizate mai multe protocoale experimentale in vitro, utilizând linia de celule senzoriale auditive HEI-OC1. Aceste celule care exprimă mai mulți markeri moleculari specifici celulelor senzoriale ale organului Corti, în condiții de cultură permisive (33 °C, 10% CO2) sunt extrem de sensibile la substanțe ototoxice.
Utilizând aceste celule și cele mai precise tehnologii și tehnici de lucru, am îndeplinit cu succes obiectivul 2 al proiectului, demonstrând că materialele nou sintetizate sunt stabile, sunt netoxice în anumite concentrații, sunt preluate de către celulele HEI-OC1 și internalizate în locații specifice tipului de biomaterial și că, în general, nu afectează viabilitatea și proprietățile biologice și secretorii ale celulelor.
A fost demonstrată preluarea GNP, a miceliilor de Pluronic și a nanoparticulelor de chitosan de către celulele HEI-OC1 (gradul de internalizare) prin următoarele metode:
- Spectrometrie atomică de absorbție. Prin aceasta s-a determinat concentrația intracelulara de aur atomic, cu ajutorul unui spectrofotometru de absorbție atomica Zeenit 700P. Analiza probelor s-a făcut prin metoda adiției standard iar rezultatele s-au exprimat în μl/ml. Cantitatea de aur internalizată de către celule HEI-OC1 a fost raportată procentual față de concentrația de aur incubată în celule. Concentrația de Au detectată în celulele HEI-OC1 a fost proporțională cu concentrația de GNP administrată și timpul de incubație. Am constatat o mai bună internalizare a GNP cu chitosan comparativ cu cele cu Pluronic.
- Microscopie optică în câmp întunecat. În cazul GNPPlu, GNPPluDex particulele sunt uniform distribuite în regiunea extranucleară a celulelor, fără să fie detectate în nucleu. Celulele incubate cu GNPChit, GNPChitDex arată în schimb o distribuție intracelulară diferită, NP fiind în multe zone aglomerate/agregate, uneori chiar și pe suprafața celulelor. Această distribuție se datorează internalizării în exces a nanoparticulelor învelite în chitosan, rezultat în concordanță cu măsurătorile de absorbție atomică.
-
Microscopie electronică de transmisie TEM. S-a urmărit modul de preluare a NP de catre celule, localizarea intracelulara a acestora, precum si efectele asupra componentelor celulare. În toate grupurile de celule incubate cu GNP respectiv GNP-Dex s-a evidențiat internalizarea acestor particule. În ce privește localizarea intracelulară, aceasta a fost diferită pentru cele 2 tipuri de NP: NP au fost observate în număr mare în endosomi și în unii autofagosomi - în cazul GNPPlu și MiceliiPluDex în interiorul lisosomilor - în cazul GNPChit și NPChitDex. Doza de NP testată nu a produs modificări de natură lezională și nici nu au fost identificate alterări ultrastructurale în celulele studiate.
MiceliilePlu și NPChit au fost de asemenea preluate de către celulele HEI-OC1 și depozitate în endozomi. Structura celulei nu s-a modificat în urma internalizării MiceliilorPlu și a NPChit. - Microscopie de fluorescență. A fost utilizată pentru evaluarea internalizării nanoveziculelor micelare de Pluronic și a nanoparticulelor de chitosan. Pentru aceasta am sintetizat micelii de Pluronic și nanoparticule de chitosan încapsulate cu dexametazonă marcată cu fluoroforul fluoresceină (DEXA-FL).
S-a făcut o evaluare a toxicității și a efectului NP și soluțiilor nanoveziculare asupra celulelor aparatului auditiv cu ajutorul testelor de măsurare a:
- Viabilității celulare: testul MTT, în care ototoxicitatea compușilor s-a calculat prin % celulelor viabile după tratament raportat la % celulelor viabile netratate iar IC50 s-a calculat folosind regresia neliniară și curbe sigmoide cu patru parametri. IC50 (concentratia care a redus viabilitatea cu 50%) a fost de 37.7 µg/ml pentru GNPPlu; 38.8 µg/ml pentru GNPPluDex; 24.7 µg/ml pentru GNPChit si 23.2 µg/ml pentru NPChit Dex. Ca urmare, pentru experimentele următoare, s-au ales două concentrații aflate sub IC50 în cazul tuturor NP și anume 10 și 20 µg/ml. Miceliile încărcate cu Dex au avut IC50 mai mare: 53.92µg/ml, fiind astfel mai puțin toxice. Miceliile (atât cele goale cât și cele cu Dex) administrate înaintea tratării celulelor cu 100µM Cisplatin nu au dus la creșterea procentului de celule viabile comparativ cu celulele tratate doar cu Cisplatin. GNPChit cu și fără Dex au avut IC50 de 17.66 și respectiv 21.4 µgDex/ml, valori mai mici comparativ cu miceliile de Plu, însemnând toxicitate mai mare. Din nou particulele încărcate cu Dex au fost mai puțin toxice. In situația administrării în plus a Cisplatin, GNPChit nu au protejat celulele față de toxicitatea dată de acesta.
- Apoptozei: prin flow-citometrie, utilizând kitul de apoptoza cu Anexina V marcată cu Alexa Fluor 488 și iodura de propidiu, și prin microscopie în fluorescență cu ajutorul aparatului Zeiss Axiovert D1 cu faza inversată.
- Stressului oxidativ produs de NP: determinarea speciilor reactive de oxigen (ROS) cu dichlorofluorescein diacetat (DCFDA) la un cititor de placi BioTek Synergy 2.
- Secreției de citokine inflamatorii TNFα și IL6 cu ajutorul tehnicii ELISA, la spectrofotometrul Tecan Sunrise 450nm.
Al 3-lea obiectiv al proiectului a fost îndeplinit în totalitate și a constat în evaluarea efectului protectiv al Dexametazonei libere și înglobate în NP împotriva ototoxicității induse de Cisplatin. Această evaluare s-a făcut atât in vitro, pe celulele HEI-OC1 în cultură, cat și in vivo, pe animale cărora li s-a indus surditatea cu Cisplatin. Pentru studierea eficacității otoprotecției oferite de nanoparticulele nou sintetizate încărcate cu dexametazonă s-au folosit pe post de bioreactor șobolani Wistar. Acestora li s-a indus ototoxicitate prin administrare intraperitoneală de Cisplatin. Ulterior, prin injectare transtimpanică li s-a administrat atât dexametazonă simplă, cât și nanoparticule încărcate cu dexametazonă pentru a compara nivelul otoprotecției oferite de fiecare în parte. Toate experimentele in vivo au fost efectuate în cadrul Biobazei UMF.
Evaluarea in vitro a efectului protector al Dexametazonei libere și înglobate în NP asupra celulelor HEI-OC1 tratate cu Cisplatin s-a făcut prin:
- Eliberarea de specii reactive de oxigen (ROS). Prin metoda cu diclorofluoresceindiacetat (DCFDA), s-a constatat că valorile ROS induse de Cisplatin au crescut odată cu timpul de expunere, cu max la 24h. Când celulele au fost tratate cu GNPs, ambele tipuri de GNPs au dus la scăderea valorilor ROS la toate intervalele de timp și concentrațiile, concentrația mai mică fiind mai eficientă (semnificație statistica la toate tipurile de particule). La concentrația de 20µg/ml, doar la 24h scăderea ROS a fost semnificativă in cazul celulelor tratate cu GNPChit cu și fără Dex și Cisplatin.. Miceliile de Plu nu au dus la creșterea eliberării ROS din celulele HEI-OC1 comparativ cu controlul netratat. In situația în care anterior administrării Cisplatinului, celulele au fost pretratate cu micelii goale sau încărcate cu Dex s-a constatat scăderea semnificativă a ROS comparativ cu valoarea dată de tratamentul cu Cisplatin singur. În ceea ce privește NPChit, pretratamentul cu acesta, cu și fără Dex, nu a dus la scăderea semnificativă a ROS induse de Cisplatin.
- Cuantificarea apoptozei prin flow-citometrie a arătat că Cisplatinul induce moarte celulară, atât apoptoză cât și necroză. Toate GNP administrate în prealabil duc la o scădere a procentului acestor celule similar cu protecția dată de Dex (25µg/ml). Comparând apoptoza totală la 4h, se constată o scădere semnificativă a procentului de apoptoză pentru toate celulele tratate în prealabil cu GNP de Plu și Chit, cu sau fără Dex. Cât privește miceliile de Pluronic, în cazul celulelor tratate doar cu Cisplatin avem cele mai multe celule marcate, semnificând diferite forme de moarte celulară. În cazul culturilor pretratate cu micelii și NP, avem un procent mai mic de celule marcate, semnificând un grad redus de moarte celulară și deci un efect protector al acestor compuși.
- Secreția de cytokine inflamatorii TNFα și IL6 a fost măsurată cu kiturile ELISA DuoSet și calculată pe baza curbei de absorbție cu softul Magellan 3. Am constatat ca celulele HEI-OC1 nu secretă TNFα în concentrație crescută după niciunul din tratamentele administrate, în schimb concentrația IL6 crește semnificativ în urma administrării de Cisplatin. Toate tipurile de GNP administrate înaintea Cis au dus la scăderea eliberării IL6, similar cu Dex. Am constatat că administrarea NP de Au nu este urmată de o secreție crescută de cytokine în comparație cu controlul. În schimb, toate tipurile de micelii și NP administrate înaintea Cis au dus la scăderea eliberării IL6 la valori comparativ cu controlul netratat.
Evaluarea in vivo a efectului protector. Evaluarea funcțională a potențialului efect otoprotector al nanoparticulelor considerate în studiu a constat în determinările audiologice. Evaluarea morfologică a fost realizată prin examen histopatologic.
Pentru analiza histologică s-au folosit probele obținute după sacrificarea șobolanilor, examinate cu ajutorul microscopului optic. Examinarea histopatologică a elementelor urechii interne după tratament cu Cisplatin evidențiază distrucție celulară mai marcată în spira bazală (corespunzătoare frecvențelor înalte) și celule neafectate către vârful cohleei, direct proporțional cu gradul de hipoacuzie indus de către Cisplatin fiecărui șobolan.
Ca evaluare funcțională s-au folosit potențialele evocate auditive, înregistrate înainte de injectarea Cisplatinului și la 7 zile după administrarea acestuia.
- GNPPluDex. Valorile pragurilor auditive nu au prezentat diferențe semnificative statistic la stimul click (p> 0.05). Analizând individual fiecare frecvență testată, grupul GNPPluDex a afișat o deplasare mai redusă a pragurilor auditive față de grupul Dex dar diferența dintre valorile medii pentru fiecare frecvență nu este semnificativă statistic.
- GNPChitDex. Nu au fost decelate diferențe semnificative pentru pragurile audiologice nici pentru stimul click sau pentru tonuri pure ale celor două loturi după administrare transtimpanică asociate ototoxicității induse de Cisplatin.
- MiceliiPluDex. Administrate intratimpanic au protejat mai bine frecvențele înalte față de Dex în cazul unor anumiți șobolani, fără însă a se atinge o diferență statistic semnificativă în lotul actual.
- Atât NPChitDex utilizate prin administrare intratimpanică, cât și Dex au arătat o protecție pe frecvențele înalte în lotul studiat, fără a exista diferențe semnificativ statistice între cele două opțiuni terapeutice.
Aplicând aceleași teste statistice datelor obținute la fiecare lot, rezultatele audiologice nu au pus în evidență modificări semnificative ale pragurilor auditive. Putem interpreta aceste rezultate ca tratamentul administrat prin acești vectori non-virali ca fiind non-inferior tratamentului standard. Este necesar să considerăm că aceste rezultate pot fi influențate pe de o parte de numărul redus de animale incluse în loturile experimentale. Astfel, în continuare putem evalua diferite concentrații de NP în vederea creșterii concentrației Dex ce intră în contact cu fereastra ovală și fereastra rotundă, două bariere naturale în pătrunderea compușilor studiați în urechea internă. Acest aspect este esențial de luat în considerare în continuare.
Al 4-lea obiectiv al proiectului, îndeplinit în întregime, a constat într-o integrare a rezultatelor obținute la primele 3 obiective. Prin extrapolarea modelelor experimentale s-a reușit crearea unui demonstrator experimental pentru testarea, validarea și utilizarea acestor bio-nanomateriale în studii clinice de evaluare a efectelor protective ale NPs asupra celulelor urechii interne afectate de tratamente ototoxice.
Diseminarea rezultatelor cercetarii
- Articol ISI publicat in revista Molecules, factor de impact 4,41: “Zeaxanthin-Rich Extract from Superfood Lycium barbarum Selectively Modulates the Cellular Adhesion and MAPK Signaling in Melanoma versus Normal Skin Cells In Vitro”. Din lista de autori fac parte mai multi membri ai proiectului: Eva Fischer-Fodor, Alma Maniu, Maria Perde-Schrepler, Piroska Virag.
- Articol in evaluare la o revistă cotată ISI IF=2,986 (Journal of Nanomaterials – Hindawi) cu titlul „Recent advances and future research directions for hearing loss treatment based on nanoparticles” Autori: Maximilian Dindelegan, Cristina Blebea, Maria Perde-Schrepler si Alma Maniu. Articolul a fost revizuit conform cerințelor editorilor și revizorilor și așteptăm răspunsul editorilor în legătură cu varianta revizuită a articolului.
- Participari la manifestari stiintifice:
Membri ai colectivului de cercetare au participat în calitate de lectori la „The International School of Experimental Microsurgery” Ed.6, curs organizat între 11-18 Iulie în Cluj-Napoca unde au sustinut doua prezentari: Alma Maniu- „Microsurgery in otology” si Maximilian Dindelegan- „Experimental microsurgery- headstart for a promising medical career”. - Blebea, Cristina Maria, Violeta Necula, Monica Potara, Maximilian George Dindelegan, Laszlo Peter Ujvary, Emil ClaudiuBotan, Alma Aurelia Maniu, and Marcel Cosgarea. 2022. "The Effect of Pluronic-Coated Gold Nanoparticles in Hearing Preservation Following Cochlear Implantation-Pilot Study" Audiology Research 12, no. 5: 466-475. https://doi.org/10.3390/audiolres12050047
- Dindelegan, M. G., Pașcalău, V., Suciu, M., Neamțu, B., Perde-Schrepler, M., Blebea, C. M., Maniu, A. A., Necula, V., Buzoianu, A. D., Filip, M., Csapai, A., & Popa, C. (2022). Biopolymer Lipid Hybrid Microcarrier for Transmembrane Inner Ear Delivery of Dexamethasone. Gels (Basel, Switzerland), 8(8), 483. https://doi.org/10.3390/gels8080483
O altă modalitate de diseminare a rezultatelor obținute în proiect a constat în prezentarea lor la manifestări științifice. Membri ai colectivului de cercetare au participat în calitate de lectori la manifestări științifice internaționale:
- Maria Perde-Schrepler, Ioana Carmen Brie, Maximilian George Dindelegan, Monica Potara, Alma Maniu: “Gold and polymeric nanoparticles for the delivery of Dexamethasone to the inner ear , Book of abstracts: 10th jubilee International Conference on radiation in various fields of research (RAD 2022) summer edition.
- „The International School of Experimental Microsurgery” Ed.6, curs organizat între 11-18 Iulie 2021 în Cluj-Napoca unde au susținut prezentări:
Alma Maniu - „Microsurgery in otology”
Maximilian Dindelegan- „Experimental microsurgery-headstart for a promising medical career”.
Cercetarea echipei a contribuit la două teze de doctorat ale membrilor echipei de cercetare
- Cristina Maria Blebea – Teză de doctorat cu titlul ”Metode de reducere a reacției inflamatorii la urechea implantată cohlear” – Cercetarea din cadrul tezei de doctorat urmărește identificarea unor noi metode de administrare a agenților antiinflamatori în urechea internă după implant cohlear. Unul din studiile experimentale cuprinse în teza de doctorat implică folosirea nanoparticulelor de Aur funcționalizate cu Pluronic pentru eliberarea locală a dexametazonei după implantarea cohleară pe model animal. Rezultatele audiologice au evidențiat tendința de a proteja pragurile auditive preponderent a frecvențelor joase comparativ cu dexametazonă liberă. Teza de doctorat este în curs de susținere (susținere programată în data de 03.11.2022)
- Maximilian George Dindelegan – Teză de doctorat cu titlul ”Sistem inovativ de eliberare controlată a dexametazonei la nivelul urechii interne pe bază de microparticule” – Cercetarea din teza de doctorat urmărește sintetizarea și testarea de noi platforme de eliberare controlată a dexametazonei la nivelul urechii interne pentru tratamentul hipoacuziei de cauză ototoxică în fază acută și a surdității brusc instalate. Unul din studiile cuprinse în cadrul tezei de doctorat a constat în studierea literaturii de specialitate din domeniu și publicarea unui articol de tip review narativ în legătură cu stadiul actual al cunoașterii în tratamentul hipoacuziei bazat pe nanoparticule. Studiile experimentale din cadrul lucrării de doctorat constau în compararea diverșilor compuși activi (microcapsule, nanoparticule) nou sintetizați ce permit eliberare controlată de dexametazonă și nivelul de protecție oferit de către aceștia în cadrul hipoacuziei indusă de ototoxice.
Consideram ca obiectivele propuse pentru aceste etape au fost indeplinite in totalitate, cu obtinerea unor rezultate valoroase care pun bazele cercetarii propuse in acest proiect. S-a obtinut sinteza unor nanoparticule proteice (Chitosan si Pluronic) incarcate cu Dexametazona care dupa ce au fost preluate de catre celulele urechii interne s-au dovedit a fi netoxice, neafectand celulele neurosenzoriale ale urechii interne. De asemenea in vivo, administrarea lor nu a produs afectarea auzului animalelor de experienta, astfel, ele vor putea fi folosite in cercetarile viitoare ca agenti de protectie impotriva ototoxicitatii Cisplatinului.
Prezentare succintă a rezultatelor obținute în cadrul proiectului
Contact
Alma Maniu, Conferențiar, Doctor în Medicină
Department ORL, Universitatea de Medicină și Farmacie Iuliu Hațieganu, Cluj-Napoca, România
E-mail:



